



钠离子通道α1亚基蛋白基因SCN1A是单基因癫痫相关疾病最常见的致病基因。SCN1A基因相关的癫痫表型包括广泛的临床谱系,包括单纯的热性惊厥(FS)、轻度遗传性癫痫伴热性惊厥加重(GEFS+)、早发婴儿型癫痫脑病Dravet综合征、全身性强直-阵挛性发作(ICE-GTC)、重症边缘型肌阵挛癫痫(SMEB)、偏瘫型偏头痛、癫痫性猝死(suddenunexpected death in epilepsy,SUDEP)等等。
其中婴儿早期发作的SCN1A相关癫痫疾病中最难以分辨的是Dravet综合征和GEFS+。前者是一种严重的癫痫脑病,具有难治性、影响智力发育及死亡率高的特点;而后者常常属于家族性良性病程的癫痫发作,大部分不影响认知发育。对于两种疾病谱系的早期识别和分类对于患儿的治疗和预后有重要意义,也一直是学界的重点和难点。过去,两种疾病的分辨很大程度上依赖于临床医师的经验,普遍来说认为更早的发病年龄和/或更具有危害性的变异(null mutation)可能与Dravet综合征高风险相关。

在这篇文章中,研究者建立和验证了一个新的预测模型用于分辨SCN1A突变患儿更有可能导致Dravet综合征或GEFS+,该模型也已经公开在相关网站上https://scn1a-prediction-model.broadinstitute.org/。
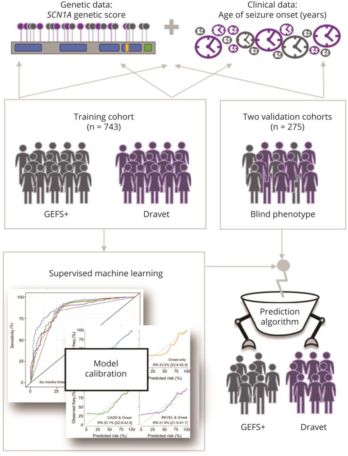
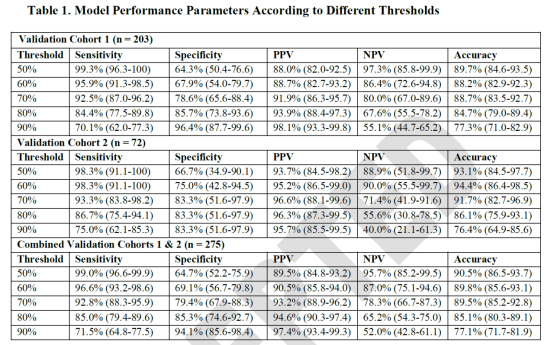
研究者选用了来自多中心、回顾性的SCN1A患儿数据,训练集和验证集共包含1018名个体,其中训练集为743人,验证集为203人。Dravet综合征患儿的比例分别为83%(616/743)和72%(147/203)。SCN1A的突变采用了一定的规则进行了评分,主要参考了变异类型、CADD及revel分值,在Dravet及GEFS+中,两者存在显著差异(133.4 (SD, 78.5) Vs. 52.0 (SD, 57.5; p < 0.001));此外,发病年龄在两组间也存在显著差异(6.0 个月(SD, 3.0) Vs. 14.8个月 (SD, 11.8; p < 0.001) 。经过不同参数的模型模拟,最终建立了一个模型,综合考虑SCN1A遗传分值和发病年龄,可达最佳准确性,在训练集及两个验证集中其AUC可达0.89、0.94和0.92。进一步的分析发现,在最终模型中发病年龄因素相对而言更为重要,大概占比为遗传分值的2.6倍。
该模型可以辅助临床医师进行SCN1A基因突变的癫痫患儿的临床分层,在实际的应用中,在模型中输入变异信息及发病年龄可以得到一个Dravet综合征的可能概率值。在衡量是否需要尽早启动相应的治疗策略时,医师可以评估治疗策略可能的副作用、风险和收益,灵活选用不同的阈值。
实例测试:我们选择了既往检测中曾经检出了SCN1A基因变异的三个癫痫案例进行了测试。
案例1:9 月时发作,局灶性癫痫,智能发育重度迟滞,共济失调,下肢腱反射亢进,运动功能差。检出新发变异c.4972_4975del (p.Thr1658Cysfs),变异评级为P。
案例2: 10月龄起多次发热惊厥;6岁多出现两次无热惊厥,眼斜视伴意识障碍,持续 1-2min,7岁出现两次热性惊厥。头颅核磁:髓鞘化不良,VEEG:广泛性棘慢波。母亲6岁前有热性惊厥史。检出来自母亲的杂合变异c.3734G>A(p.Arg1245Gln),变异评级LP。
案例3:4月龄左右首次发作,局灶性发作、核磁脑电图无异常,自述无家族史。检出来自母亲的杂合变异c.2714C>T(p.Ala905Val),变异评级LP。
三个案例的预测结果为Dravet综合征可能性92.98%、54.31%和92.42%。基于上述的预测结果,第1和3例的患儿是Dravet综合征的可能性极高,PPV大于95%,尽管第3例患儿目前还没有看到MRI异常,但是也许也需要积极进行对应的治疗。第2例患儿是Dravet综合征的可能性也很高,PPV大于89.5%。由于目前患儿的年龄比较大,已经出现了一定的发育障碍。